摩登7平台合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
-
> 墙体基面界面剂粘结强度影响因素有哪些
> 温度对陶瓷墨水的容重、表面张力、粘度参数的影响
> 桐油基衍生物钠盐的表面张力、CMC值测定、乳液稳定性、固化膜性能测试(三)
> 一种磺酸盐类的高分子活性剂合成、分子结构及对油田污水回注效率影响
> 摩登7表面张力仪使用指南【专业版】
> 不动杆菌菌株XH-2产生物表面活性剂发酵条件、性质、成分研究(三)
> pH、温度、盐度、碳源对 解烃菌BD-2产生物表面活性剂的影响——结果与分析
> 表面张力仪测试添加消泡剂后起泡液、水性丙烯酸胶黏剂的变化(一)
> 热力学模型计算MgO-B2O3-SiO2-CaOAl2O3富硼渣表面张力(二)
> 激光钎涂金刚石的涂层形成与表面张力有何关系(二)
Delta-8食用餐食后人体内十二指肠液的组成及性质——结果和讨论、结论、致谢!
来源:上海谓载 浏览 2227 次 发布时间:2022-01-10
结果和讨论
酸碱度
图1显示了五名受试者在三种营养状态下最初获得的15分钟部分的pH值-时间演变。在禁食状态下,随着时间的推移,受试者之间的变异性以及受试者内部的变异性是相当大的。因此,很难确定禁食状态下的一个代表性pH值。尽管如此,尽管在其他已发表的研究中也报告了禁食状态pH值的变化,但获得的整体禁食状态pH值中值6.5在6.1-7.0的范围内,如文献中发现的上小肠。19,24–26
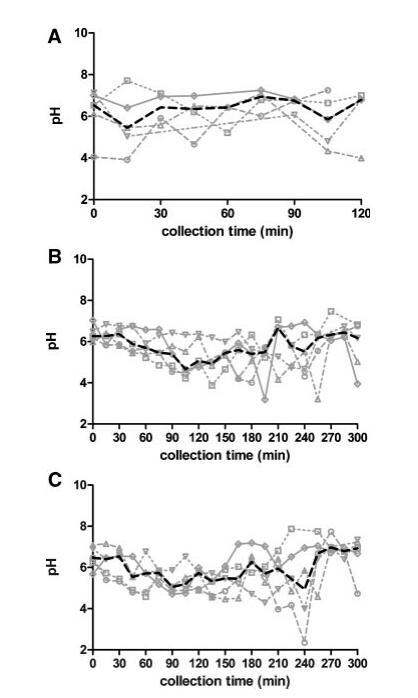
图1。五名健康受试者在禁食(A)、喂食(B)和富含脂肪的喂食(C)状态HIF中的个人和中值pH值随时间的变化。(--◯--)主题1(··☐··)主题2,(·–·)△·–·)主题3,(·-·▽·–·)主题4,(-◇–)受试者5,(――中位)。
在进食后的前3小时内,摄入液态食物导致受试者之间的变异性降低,两种喂养状态下的差异不显着。由于确保Plus1和Scandishake Mix1具有几乎相同的pH值,这可能是两种喂食条件下在所检查的时间段内没有出现实质性pH值差异的根本原因。似乎给药餐的pH值对局部pH值也有很大影响,但随着更多食糜从胃流向十二指肠,pH值降低。这两种喂食状态下pH值的降低导致在喂食状态和富含脂肪的喂食状态下90到150分钟之间采集的样本与整体禁食状态pH值中值(6.5)之间存在显着差异。在取样期的最后2小时内,pH值和可变性逐渐上升到禁食状态下观察到的pH值条件。给药300分钟后,pH值已恢复到起始值(图1)。
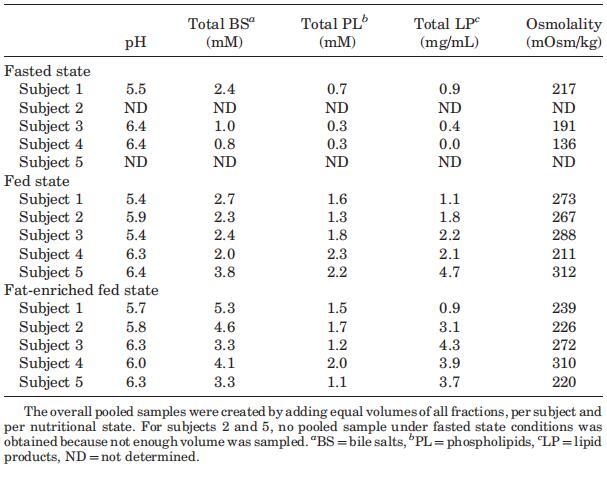
如材料和方法部分所述,还生成了每个受试者的HIF汇总样本(表1)。合并样本的pH值似乎是相对较好的各个中间值估计值,因为未观察到显着差异(表2)。然而,混合样本的中值pH值和pH值均未反映吸入时间函数中观察到的变异性。其他人也报告了图1中所示的类似的时间相关曲线。19,25 Dressman等人和Kalantzi等人(分别为3.1和5.2)的研究中达到的最小pH值与图1中各个剖面中观察到的3.9–4.9的值相似。不同的方案可能是观察到的差异的根源(测量方法、25,26类型、25给药率和给药路线19、采集时间点、小肠/十二指肠的位置、参与研究的受试者人数);因此,在比较不同研究的价值时应谨慎。
脂质消化产物的浓度
确保Plus1和Scandishake Mix1分别含有4.92 g/100 mL(热量摄入的29%)和10.13 g/100 mL(热量摄入的46%)脂肪。两种液体膳食中的脂肪几乎完全由TG组成,微量(总共0–1%)有MG、DG和FFA(来自制造商的信息)。两餐的摄入都会导致十二指肠脂肪消化产物的浓度波动。图2显示了五名个体受试者在进食后一段时间内十二指肠吸出物中这些脂质产物的演变。无论是在考虑总脂浓度还是在考虑TG、DG、MG和FFA的相对分布时,都没有观察到明显的时间函数趋势。
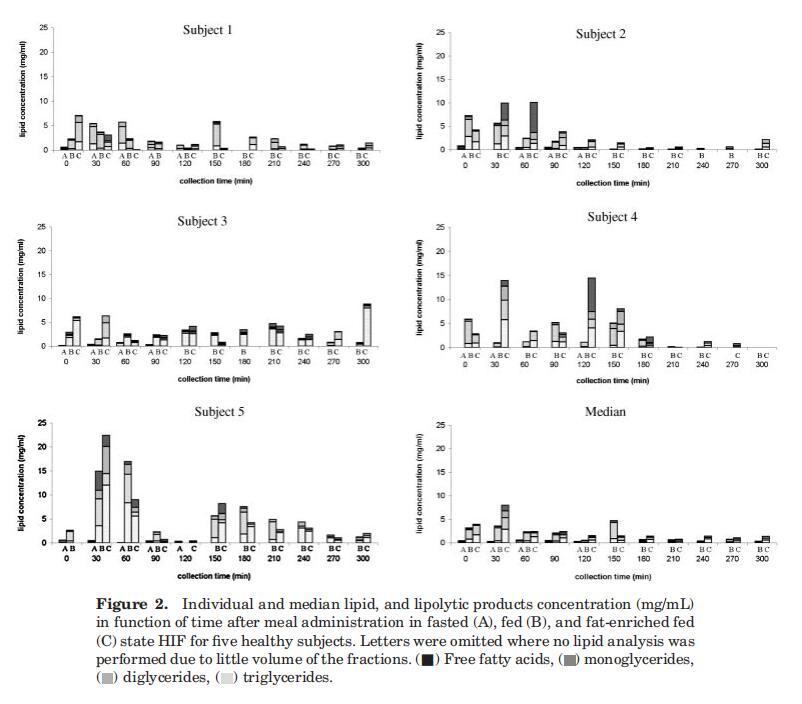
因此,根据这些数据,TG和DG、MG或FFA之间没有相关性。受试者的总脂质浓度差异很大。与受试者4和5相比,受试者1、2和3在喂食条件下的十二指肠总脂浓度通常较低。Hernell等人也描述了从Treitz角度取样的十二指肠脂质含量的显着受试者间差异。27除了明显的受试者间差异外,个体浓度也随时间波动。受试者体内的这种变异可能由多种因素解释,包括胃排空的变化、胃肠道的扩散、同时进行的消化和吸收以及肠道内容物的不均匀分布。利用磁共振成像(MRI),Weitschies及其同事最近证实了肠道内液体的不均匀分布;28肠液被称为在水囊中分离;此外,研究还表明,进食后小肠液体总量显着减少。胰脂肪酶在油水界面发挥作用;因此,脂肪分解消化产物预计将在这些水袋的直接环境中释放。由于水分室不连续分布,脂肪分解产物在小肠中也不均匀分布。这可以解释剖面中观察到的可变性。然而,在五名受试者中,随着时间的推移计算出的总脂质浓度中值显示,在给药30分钟后浓度降低,在给药120分钟后达到稳定状态(图2)。由于个别pro文件有时与此中间配置文件存在很大差异,因此平均配置文件的有用性可能会受到质疑。29,30然而,这一中位数曲线确实与先前的研究一致,在之前的研究中,摄入食物后约1小时,脂质浓度处于稳定状态,持续3小时。11,12,31稳态期间描述了恒定的TG浓度,而FFA浓度增加或恒定。在之前的每一项研究中,FFA水平在每个测量点都高于镁水平;计算得出该比率约为3-6。相反,目前的数据集指出,在整个收集期内,镁是主要成分,其次是FFA。TG的含量通常非常少或无法检测到。这可能意味着膳食TG的快速水解,从胃脂肪酶开始。其他人也提出了类似的意见。11,31当将这些数据与以前提出的肠道脂质浓度进行比较时,应注意到以前的浓度始终以摩尔水平表示,而在本研究中,结果以w/v浓度单位表示。因此,MG/FFA的比率在以重量为基础表示时将以牺牲游离脂肪酸为代价进行移动,当然对于由长链脂肪酸组成的脂质材料而言。
表1。三种营养状态下汇集样本的腔内参数
对于四名受试者(S2、S3、S4、S5),在禁食状态HIF中发现微量脂质(平均0.4?0.3 mg/mL),这与Armand等人12报告的受试者1十二指肠吸出物中的禁食水平0.6 mg/mL相符,禁食状态下的脂质浓度等于或高于30-120分钟期间在喂食和富含脂肪的喂食状态下测定的浓度(图2)。这一观察的可能原因可能与胃滞留时间和/或小肠上皮细胞的周转率有关,从而释放膜脂。在喂食和富含脂肪的喂食状态之间,根据个体特征,没有发现实质性差异。然而,中位数曲线显示,进食30分钟后,在高脂肪喂养状态下,总脂质浓度显着增加。由于没有观察到脂质产物在管腔内出现延迟,因此可以得出结论,服用液体膳食的脂肪含量的应用差异不会改变胃排空。先前已经证明,给予恒河猴的碳水化合物、蛋白质和脂肪等热量负荷产生了相似的胃排空率,这表明胃排空是根据膳食的热量密度进行调节的,而不管其营养成分如何。32
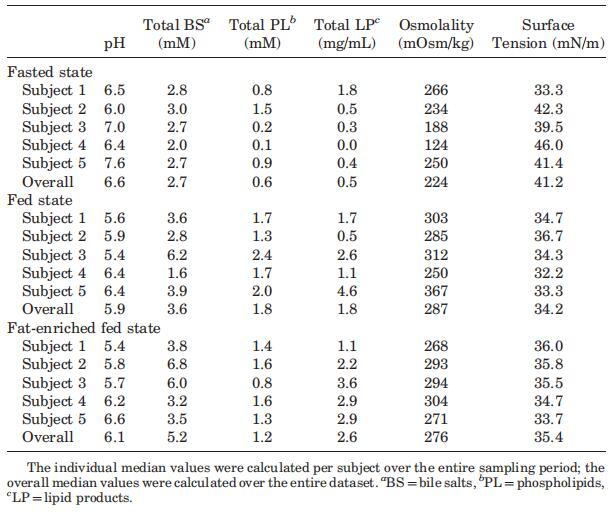
表2。三种营养状态下个体和整体中值的腔内参数
胆盐浓度
当考虑五个不同的受试者时,总胆汁盐浓度随时间的变化在所有三种营养状态下都呈现波动模式(图3)。无法定义可应用于每个单独图表的清晰的浓度-时间曲线。文献中也报道了喂食条件下胆汁盐浓度的高度变化。可以找到高达37 mM27和低至0.5 mM33的值;然而,文献中观察到的典型胆盐浓度约为10mm,在进食后30–60分钟检测到。11,12,19,33在本研究中,摄入Sure Plus1后30分钟,胆汁盐浓度中值为8.3 mM;在高脂肪喂养状态下,30分钟后获得的中值为11.9 mM。这些中值与文献中观察到的典型值一致。相比之下,五名登记受试者的单独汇集肠道样本显示,在两种喂养状态下,总胆汁盐浓度均低于5.3 mM。同样在禁食状态下,当不存在胆囊收缩刺激时,可以看到高度可变和时间依赖性的胆盐浓度:浓度范围为0.3至9.6 mM(图3)。Lindahl等人的一项研究也描述了类似的高变异性。34作者报告了24名志愿者的禁食状态胆盐浓度,范围在0.1至13.3 mM之间,总收集时间为150分钟。Brouwers等人2和Perez de la Cruz Moreno等人24也报告了禁食状态下的胆盐浓度单个志愿者的小肠,分别为1.0至5.3 mM和0.5至5.5 mM。使用当前数据集计算的个体胆汁盐浓度中位数显示出较小的受试者间变异性,最小值为2.0 mM,最大值为3.0 mM;总体中值为2.6 mM(表2)。这些中值与禁食状态下报告的胆盐水平相当吻合:之前的文章描述了禁食状态下总胆盐浓度在2.0和5.9mm之间。11–13,19与当前设置中采用的120分钟的总取样周期相反,在后述报告中使用单时间点测定来评估空腹水平。11–13,19
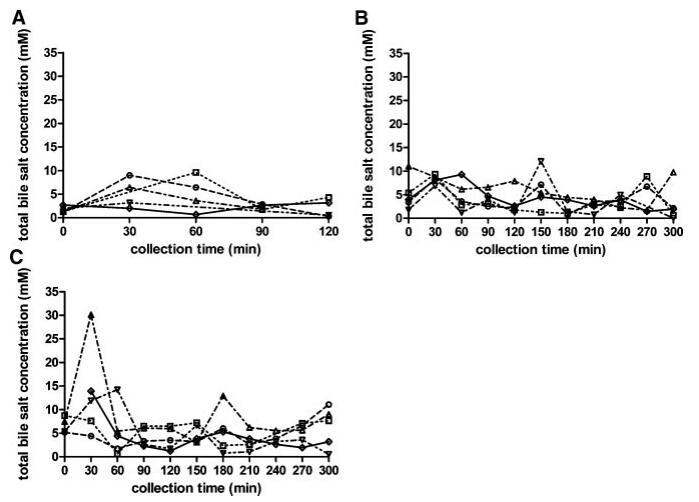
图3。在禁食(A)、喂食(B)和高脂喂食(C)状态HIF中,总胆汁盐浓度(mM)随餐后给药时间的变化。(--◯--)主题1(··☐··)主题2,(·–·)△·–·)主题3,(·-·▽·–·)主题4,(-◇–)科目5。
尽管在较低程度上,当检查受试者的胆汁盐池成分时,也观察到了一种可变模式(表3)。胆酸盐和鹅去氧胆酸盐(结合胆汁盐和未结合胆汁盐之和)至少占总胆汁盐库的65%,脱氧胆酸盐和熊去氧胆酸盐(结合胆汁盐和未结合胆汁盐之和)虽然含量较少,但在每个样本中都发现。文献报道了禁食状态HIF胆汁盐池成分的主体间变异性。2,24在这些研究中,变异性主要是由于胆盐与甘氨酸或牛磺酸结合,因为未结合的胆盐仅占总胆盐库的不到3%。研究发现,随着时间的推移,个体内胆汁盐组成以及营养状态之间的一致性相对较高,很少排除异常值(表3)。例如,对于S3和S5,在三种营养状态下,在整个取样时间内,相对胆盐组成相当一致,而对于S4,胆酸的分数在38%和90%之间变化(表2)。
尽管Coure Plus1和Scandishake Mix1在脂肪热量含量方面存在16%的差异,但在考虑个别胆盐浓度时,禁食、喂食和富含脂肪的喂食状态之间没有统计学上的显着差异。相比之下,当比较S1、S2、S3和S4混合样本中的胆盐浓度时,两种喂食状态之间出现了统计上的显着差异(表1)。由于两种喂食状态之间的个体浓度没有显着差异,可能是由于报告的高可变性,我们还计算了总胆盐浓度-时间曲线的AUC0–300 min值,以便比较不同营养状态下胆盐分泌的程度。AUC0–300分钟的数值显示,服用富含脂肪的膳食后,管腔内胆汁盐总量在统计学上显着增加。与禁食状态(789 mM min)的估计平均AUC值相比,高脂喂养状态(1644 mM min)的平均AUC值高出两倍以上(p¼0.013)。与禁食状态相比,喂食状态下AUC0–300分钟增加的高受试者间变异性范围在21%到114%之间,因此喂食状态下总胆汁盐水平的增加(平均增加68%)没有达到统计学意义。这些数据表明,饮食脂肪含量影响胆囊收缩。Froehlich等人35研究了营养脂肪对人体胆囊排空的重要性。该研究中的数据表明,摄入25克可引起最大胆囊收缩。一顿含有8克脂肪的混合餐,相当于卡路里摄入量的29%,与无脂餐的水平相似。Stone等人36进行的一项研究将10克膳食脂肪视为最大胆囊排空刺激的阈值。10克营养脂肪的阈值可以解释喂食和富含脂肪的喂食状态之间AUC水平的无显着差异,因为两者都确保Plus1和Scandishake Mix1的脂肪含量超过10 g的阈值,这意味着在两种营养状态下胆盐的最大释放量。
表3。餐后不同时间的个体相对胆汁盐池成分(%)a
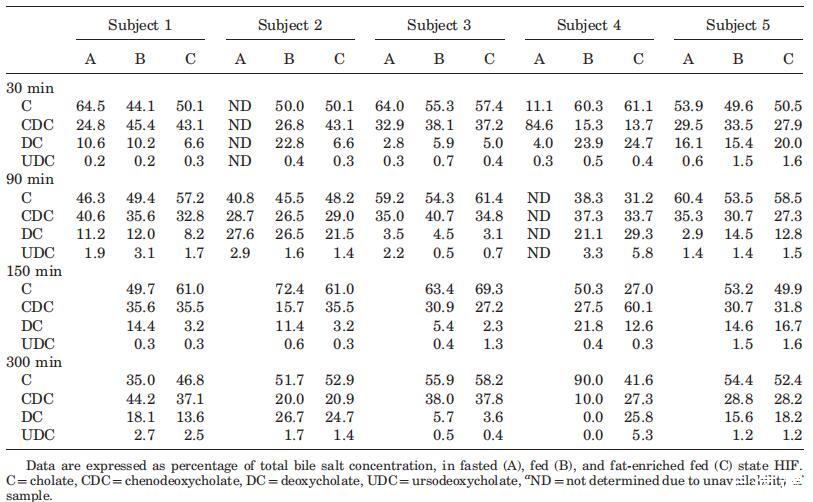
总磷脂浓度
与脂质产品和胆汁盐类似,在所有三种营养状态下,取样人体液中的磷脂浓度显示出可变的个体浓度-时间曲线(图4)。所有受试者在禁食状态下计算的总体中值为0.6 mM。然而,在禁食的上小肠中可以发现高达2.7mM的浓度。胃肠道环境中的磷脂浓度尚未像胆汁盐那样被广泛研究。文献报道了禁食状态下总磷脂浓度在0.03和0.2 mM之间。2,13这些值远低于本研究中测得的浓度。值得一提的是,Persson及其同事测定了混合HIF中的空腹磷脂水平;因此,没有考虑个体间的变异性。当分析合并样本时,本研究显示,在Persson等人13的研究中发现,磷脂浓度(表1)接近0.2 mM。可能是由于受试者之间以及受试者内部的高变异性,三种营养状态下的十二指肠磷脂浓度没有发现统计上的差异。此外,磷脂浓度随时间的变化趋势不明显。然而,那些在进食后一段时间内对磷脂浓度进行评论的文章报道,磷脂浓度随时间的变化而降低。11,12,37尽管在浓度-时间演变上存在差异,但在当前设置中,摄入Sure Plus1或Scandishake Mix1后测定的所有磷脂浓度均在上述文章中报告的浓度范围内。11,12,37
为了更清楚地了解在给药液体餐消化过程中分泌的磷脂总量,我们计算了整个采样周期内的AUC值。这表明,尽管受试者之间存在较高的变异性,且不考虑膳食中的脂肪含量,但在给药后的前5小时内,食物摄入导致管腔内磷脂水平显着升高;禁食状态下的估计平均AUC为208 mM min,而喂食状态和富含脂肪的喂食状态下的平均AUC值分别为617 mM min和532 mM min(喂食状态和富含脂肪的喂食状态下的平均AUC值分别为p¼0.016和0.046)。
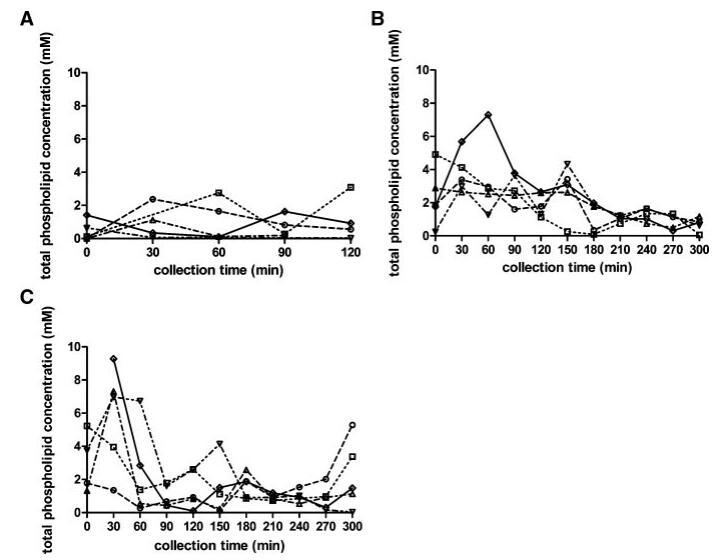
图4。在禁食(A)、喂食(B)和高脂喂食(C)状态下,总磷脂浓度(mM)随餐后时间的变化而变化。(--◯--)主题1(··☐··)主题2,(·–·)△·–·)主题3,(·-·▽·–·)主题4,(-◇–)科目5。
在胆盐浓度部分,也观察到禁食状态下AUC0–300分钟的差异,尽管这只是在高脂肪喂养状态下的情况。这可能表明进食后磷脂分泌增加多于胆盐释放;禁食状态下较高的胆盐/磷脂比率无法证实这一假设。在禁食状态下确实出现了一些非常高的比率(S3 60分钟为30,S4 30分钟为53),但这通常是无效的。最近的一项研究也计算了禁食状态下十二指肠液中类似的高比率。2在两个联邦州,除了一些异常值外,计算的胆盐/磷脂比率与早期报告一致。摄入食物后,通常会发现比例为2–4:1。11,12,27
渗透压
图5显示了禁食、喂食和富含脂肪的喂食状态下,渗透压随采集时间的变化。给药后的变异性低于餐后摄入。在喂食状态下,直到进食后240分钟,变异性都很高。考虑到整个取样期和所有五名受试者,在喂食和富含脂肪的喂食状态下,分别获得了122至516 mOsm/kg和174至619 mOsm/kg的值。对于禁食状态,数值范围为81至306 mOsm/kg。Kalantzi等人19发现了类似的范围,他们报告了9-12个个体的箱线图,但没有报告个体轮廓。根据图5所示的数据,无法检测到描述渗透压随时间变化的一致曲线。受试者1、2和5的特征是摄入膳食后90分钟内达到最大值。相比之下,受试者4的渗透压随时间增加,在喂食和富含脂肪的喂食状态下,分别在210分钟和150分钟达到最大值。受试者3十二指肠内容物的渗透压在进食后的整个5小时内保持相对恒定。
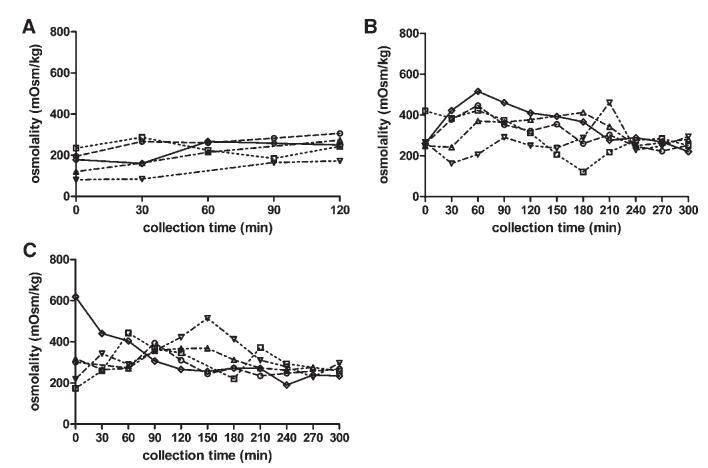
图5。在禁食(A)、喂食(B)和富含脂肪的喂食(C)状态HIF中,渗透压(mOsm/kg)随餐后给药时间的变化。(--◯--)主题1(··☐··)主题2,(·–·)△·–·)主题3,(·-·▽·–·)主题4,(-◇–)科目5。
摄入Sure Plus1或Scandishake Mix1后前2小时的渗透压通常高于禁食状态下的HIF,尽管禁食状态和两种喂食状态之间未达到显着差异。禁食状态渗透压值一般为低渗透,或接近等渗透值。224 mOsm/kg的总体中值为低渗透性,与Brouwers等人1和Deferme等人报告的人类十二指肠吸出物的平均渗透压一致。,38但高于Perez de la Cruz Moreno等人报告的平均值。24在给药(n¼3)后,在混合样品中获得的渗透压较低,与Kalantzi等人11和Gisolfi等人报告的渗透压较好。39在喂食和富含脂肪的喂食状态下均发现高渗值,尤其是在消化的前3小时。在喂食和富含脂肪的喂食状态下,总的中位数渗透压为等渗透压(分别为285和278 mOsm/kg)。进食后180分钟内较高的渗透压与胆汁盐浓度、磷脂或脂质产物总量无关。Kalantzi等人19将吸入十二指肠内容物的高渗值归因于双糖和果糖复合碳水化合物的存在,以及后者的缓慢吸收。在本研究中未确定总碳水化合物水平,因此,该陈述无法验证。
表面张力
Sure Plus1和Scandishake Mix1的表面张力分别为50.5和45.8 mN/m。这些值可能是由于Sure Plus1中存在卵磷脂,Scandishake Mix1粉末中加入乳化剂,以及液体膳食中存在的表面活性蛋白质。图6显示了在取样肠道部分中测量的表面张力随收集时间的变化。表面张力值相对稳定;与禁食状态相比,美联储状态下的波动更小。餐后三小时的摄入量变异性略有增加,这与pH值的分布相一致,在取样期的后半段,pH值的变异性也有所增加。
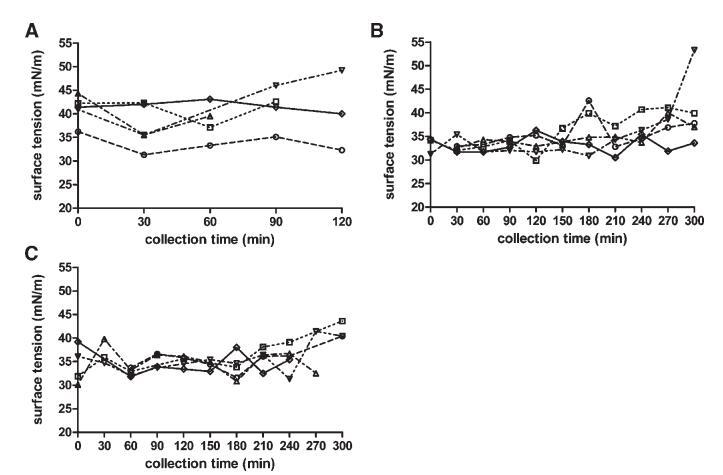
图6。在禁食(A)、喂食(B)和高脂喂食(C)状态下,表面张力(mN/m)随餐后时间的变化。(--◯--)主题1(··☐··)主题2,(·–·)△·–·)主题3,(·-·▽·–·)主题4,(-◇–)科目5。
所有取样十二指肠部分的表面张力均显着低于水的值(72 mN/m)。摄入液态膳食后,表面张力低于膳食本身的值。在最初的150分钟内,这一点更为明显,因为随后出现了表面张力增加的趋势。在膳食消化过程中形成和/或内源性分泌的两亲物(MG、FFA、胆盐和磷脂)很可能是观察到的表面张力降低的主要原因。这也导致喂食和富含脂肪的喂食状态下的个体值和禁食总中值(41.2 mN/m)在餐后60至240 min之间发生显着变化。然而,这无法通过比较三种营养状态下的个体中值来证实(表2)。最近的一篇文章也报道了摄入Sure Plus1后不同时间点的表面张力与摄入30分钟后采集的HIF相比有显着差异。19
结论
在本篇文章中,人类十二指肠内容物在进食后的一段时间内就几种不同的肠道参数进行了表征,包括pH值、脂解产物、胆盐、磷脂、渗透压和表面张力。据我们所知,之前从未进行过摄入不同营养成分膳食后十二指肠液的受试者内表征。由于研究方案可能在多个方面有所不同,并且由于不同类型的试验餐在整个文献的不同研究中使用,结果的比较并不总是简单的。上述结果清楚地说明了所有检查的腔内参数在个体之间的高度可变性。此外,这些参数随时间变化的波动增加了复杂性。因此,不能假设管腔内成分随时间的具体趋势。这意味着餐后肠道内容物的特征不容易在每个参数的单个值或时间曲线中呈现;主体内和/或主体间变化的重要性不会被提出。数据表明,通过报告单一代表性值,可变性将被掩盖;汇集的HIF样本以及计算的中隔的腔内参数值通常与文献中报告的典型值一致,这一事实证实了这一点。作为一个实际的折衷方案,最近有人提议使用三种不同的模拟肠液来表示餐后肠道环境。40腔内参数值的变化可能是一组因素的结果,包括可变的胃排空、沿胃肠道的扩散、同时进行的消化和吸收以及不均匀分布的肠道内容物。肠道液体可能分布到水袋28是最近的观察结果,需要进一步研究。鉴于本研究中观察到的变异性,可以建议增加志愿者人数。然而,估计用于检测研究中每个物理化学参数存在差异的最小受试者人数并不容易,因为可变性水平随参数而变化。
服用Sure Plus1或Scandishake Mix1后,确定的肠道参数的时间曲线没有实质性差异。应根据体内药物溶解度和生物利用度来解释所提出的结果。高度可变的腔内成分可能导致高度可变的药物溶解和增溶,这取决于到达十二指肠的时间,可能是喂养状态下肠道吸收变化的重要来源。30如果十二指肠内事件对其肠道吸收很重要(例如,II类化合物在十二指肠内的溶解),这也可能导致体外-体内相关性的变异。然而,平均轮廓可能证明其在验证体外设置中的有用性。
致谢
这项研究由佛兰德斯科学技术促进创新研究所(IWT Vlaanderen)的博士学位资助,以及佛兰德斯“voor Wetenschapelijk Onderzoek(FWO)”基金会和比利时鲁汶大学“Onderzoeksfonds”基金会的资助。我们还要感谢Rita Vos和Toon De Greef(比利时鲁汶大学医院胃肠病学)在体内研究期间提供的帮助。感谢Kelly Swinney(比利时比尔斯强生公司)在表面张力测量期间的协助,感谢Diny Knol和Irene Samwel(荷兰弗拉丁根联合利华食品与健康研究所)在脂质GC测量方面的帮助,卢卡斯教授(德国波恩大学临床药理学系)负责他在胆汁盐测量中的合作。










